Mahli Zecher, Dr. Bastian Thaa
Wie man klinische Studienberichte effizient schreibt
Der klinische Studienbericht (Englisch: Clinical Study Report; »CSR«) ist eine objektive Berichterstattung über die Durchführung und die Ergebnisse einer klinischen Studie und ist somit ein sehr wichtiges Dokument für die Arzneimittelzulassung. Ein CSR muss nach Ende der klinischen Studie zügig erstellt werden – eine Aufgabe für einen Medical Writer. Wie ein qualitativ hochwertiger CSR am besten geplant wird, lesen Sie hier.
Die Planung
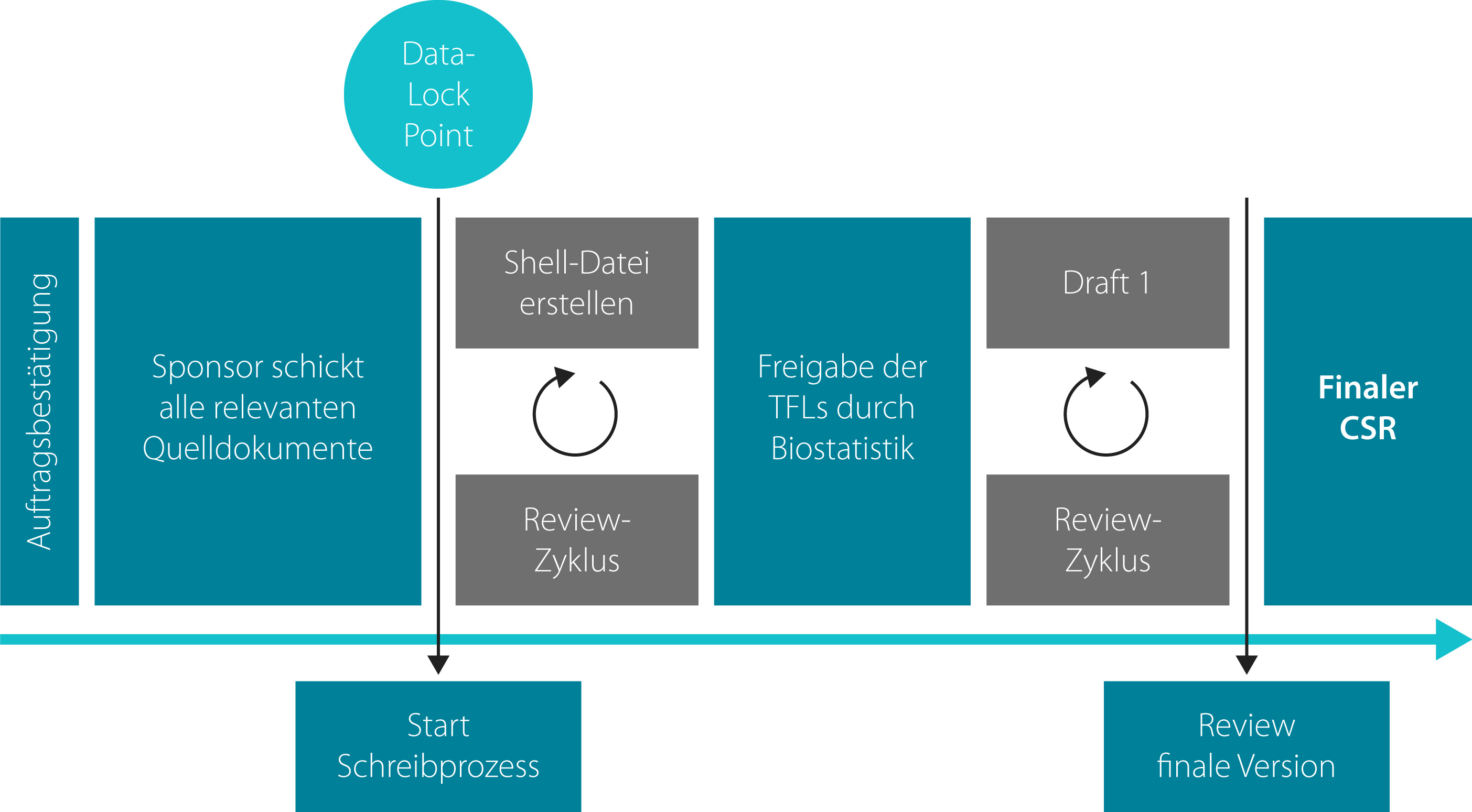
Das Rezept zum erfolgreichen Erstellen eines CSRs ist eine sehr gute Kommunikation zwischen Auftraggeber und Medical Writer. Wünsche des Auftraggebers sollten zu Beginn des Projekts deutlich kommuniziert werden, sodass gemeinsam ein Zeitplan erarbeitet werden kann. Dieser ist von diversen Faktoren abhängig, wie zum Beispiel der Komplexität der statistischen Auswertungen, der Studienphase und der Anzahl der Studienteilnehmer. Der Auftraggeber bestimmt den endgültigen Termin, an dem der finale CSR fertig gestellt sein muss. Um den Schreibprozess effektiv zu planen, sollten relevante Meilensteine der Studie, wie das Schließen der Datenbank (Data-Lock Point) oder die Verfügbarkeit der endgültigen statistischen Auswertungen (Tables, Figures and Listings; »TFLs«), berücksichtigt werden. Erst wenn die TFLs final sind, können die Teile des CSRs mit Inhalt gefüllt werden, die auf Daten der statistischen Auswertungen beruhen. Auch wenn es verlockend sein mag, vorläufige TFLs zu verwerten – dies ist eine potentielle Fehlerquelle und ist daher möglichst zu vermeiden. Um Zeit zu sparen, bietet es sich an, mit dem Schreiben derjenigen Kapitel des CSRs zu beginnen, die nicht auf den statistischen Auswertungen beruhen (Kapitel 1–10/»Shell-Datei«, siehe unten).
Die Vorbereitung
In Vorbereitung auf das Verfassen des Studienberichts sollte sich der Medical Writer ein möglichst umfassendes Wissen über die Studie aneignen. Das aufmerksame Lesen des Prüfplans liefert wesentliche Informationen zum Ablauf der Studie, zu den Ein- und Ausschlusskriterien und dem Studiendesign. Der statistische Analyseplan (SAP) verschafft ein präzises Verständnis der geplanten statistischen Auswertungen und ist für die Interpretation und Diskussion der Studienergebnisse essentiell. Wenn möglich, kann ein Biostatistiker hier beratend zur Seite stehen. Falls bereits »Case Report Forms« (CRFs; in etwa Prüfbögen oder Patientendatenerhebungsbögen) vom Auftraggeber zur Verfügung gestellt wurden, kann der Medical Writer sich bereits mit den aufgetretenen unerwünschten Ereignissen vertraut machen. Das Erstellen einer Checkliste hilft dabei, einen Überblick über fehlende Dokumente zu behalten und benötigte Informationen rasch anfordern zu können.
Der Schreibprozess bis zum finalen Dokument
Um nun den CSR zu verfassen, sollte man zuallererst ein »Template« anlegen, das man dann schrittweise mit Inhalt füllt. Dieses Template liefert entweder der Sponsor, oder der Medical Writer legt es an, unter Beachtung der entsprechenden Richtlinien (ICH E3). Daraufhin wird die »Shell-Datei« erstellt. Hier geht es um formale Aspekte wie Angaben über Prüfzentren und Ethikkommissionen sowie Informationen zur Studiendurchführung, der geplanten Studienpopulation und geplanten statistischen Auswertung. Dabei wird das vorgegebene Template mit den Informationen bestückt, die hauptsächlich aus dem Prüfplan und dem SAP zu entnehmen sind. Um möglichst effizient zu arbeiten, können Passagen aus dem Prüfplan, in die Vergangenheitsform gesetzt, an der entsprechenden Stelle des CSRs eingefügt werden. Einige Passagen müssen aber ergänzt werden, andere sind weniger detailliert zu beschreiben. Eine fertige Shell-Datei sollte von mindestens einem weiteren Medical Writer auf Vollständigkeit und Korrektheit geprüft werden. Auch der Sponsor kann natürlich verlangen, die Shell-Datei zu prüfen, um Unstimmigkeiten vorzubeugen.
Der nächste Schritt kann erfolgen, sobald die Zustimmung für die Shell-Datei vorliegt und die benötigten TFLs der Biostatistik verfügbar werden. Nun entsteht ein erster Entwurf des Ergebnis- und Sicherheitsteils (Draft 1). Im Draft 1 geht es um die Kernstücke des Berichts: die Kapitel »Ergebnisse«, »Sicherheit« und »Diskussion« (Kapitel 11, 12 und 13). Es ist üblich, Tabellen zu generieren, die ausgewählte Ergebnisse aus den TFLs zusammenfassen. Ziel ist es dabei, die voluminösen statistischen Auswertungen in verständlichen kleineren Paketen zusammenzustellen. Dieser Prozess ist je nach Größe und Komplexität der Studie aufwändig und benötigt besonders viel Aufmerksamkeit. Allgemein ist beim Beschreiben der erhobenen Daten auf eine objektive und präzise Sprache zu achten.
Der Draft 1 des CSRs wird nach Fertigstellung an den Sponsor zurückgeschickt. In der Regel finden hier mehrere Überarbeitungs-Zyklen statt, in denen weitere Drafts (Draft 2, 3, ...) entstehen, bis eine finale Version erreicht ist. Diesen Zeitaufwand sollte man schon ganz am Anfang bei der Projektplanung mit einberechnen. Die finale Version des CSRs ist in den meisten Fällen für die Einreichung an die zuständigen Behörden bestimmt. Laut gesetzlichen Bestimmungen müssen in Deutschland und auf europäischer Ebene Teile des CSRs aber auch der Öffentlichkeit zugänglich gemacht werden. Hierbei muss allerdings die Vertraulichkeit gewahrt werden, besonders im Hinblick auf Patientendaten. Eine 2016 eingeführte Initiative der EMWA und AMWA (»CORE-Reference«; Clarity in Openness and Reporting) rät, von Anfang an einen Bericht zu erstellen, der ohne eine Überarbeitung in Bezug auf vertrauliche Daten veröffentlicht werden kann – so lässt sich der zusätzliche Aufwand vermeiden, den CSR nach dem Einreichen bei der Behörde nochmals abändern zu müssen. Wenn es um Patientendaten oder Daten des Studienzentrums/-teams geht, empfiehlt es sich, folgende »3 R’s« zu beachten: Redaction (Anonymisierung), Remove (Löschen), Replace (Ersetzen). Dies betrifft insbesondere alle Adressen (außer die des Sponsors), detaillierte Angaben zu den Prüfärzten, »Case Narratives« einzelner Patienten (Fallberichte über Patienten mit besonderen oder besonders schwerwiegenden Ereignissen) und Geburtsdaten der Studienteilnehmer.
Das folgende Schema fasst nochmals kurz die wesentlichen Schritte bei der Erstellung eines CSRs zusammen, die der Medical Writer schon bei der Projektplanung und bei der Kommunikation mit dem Auftraggeber stets im Blick behalten sollte.
Fazit
Viele Schritte sind nötig, bis ein fertiger CSR steht. Neben der guten Kommunikation zwischen Medical Writer und Auftraggeber ist eine gründliche Vorbereitung und eine gute Zeitplanung für das Projekt zwingend notwendig, um das Ergebnis zum vereinbarten Zeitpunkt zu liefen. Ein Medical Writer sollte außerdem im Blick behalten, dass der CSR nicht nur von der zuständigen Behörde, sondern in Teilen auch von der Öffentlichkeit gelesen wird. co.medical bietet gerne Unterstützung beim Schreiben von CSRs – kontaktieren Sie uns.